In diesem Kapitel erfährst du mehr über die charakteristischen Merkmale von Kochsalz und wirst verstehen, wie diese mit seiner Struktur zusammenhängen.

§
© Digitale Lernwelten GmbH auf Basis von Canva
Salzkristalle kann man einfach selbst züchten
Eigenschaften von Natriumchlorid
Was weißt du bereits über die Eigenschaften von Salzen? Die Tabelle kann dir als Hinweis dienen. Denke auch an das, was du in den vorherigen Kapiteln gelernt hast.
§
Urheber: Juliana Zeidler
Im nächsten Abschnitt wirst du einige wichtige Eigenschaften, die alle Salzen besitzen, genauer betrachten.
Der Zusammenhang zwischen Bau und Eigenschaften
Sprödigkeit von Salz

§
© Digitale Lernwelten GmbH auf Basis von Canva
Was passiert, wenn man versucht, einen Salzkristall zu verformen? Drücke mit einem Löffel sanft auf einen Salzkristall und beobachte, was geschieht.
Im Gegensatz zu Metallen können Salzkristalle nicht verformt werden. Stattdessen zerbrechen sie in kleinere Kristallstücke.
Wieso zerspringt ein Salzkristall?
Die Animation zeigt die Spaltung eines Kochsalzkristalls.
§
© Digitale Lernwelten GmbH
Löslichkeit von Salz

§
© Digitale Lernwelten GmbH auf Basis von Canva
Suppe mit Salz
Wenn wir Suppe würzen, benutzen wir oft Natriumchlorid, besser bekannt als Kochsalz. Aber wie löst es sich eigentlich im Wasser auf?
Der Prozess des Lösens beginnt, wenn Natriumchloridkristalle ins Wasser gegeben werden. Wie du weißt, bestehen diese Kristalle aus positiv geladenen Natrium-Ionen (Na⁺) und negativ geladenen Chlorid-Ionen (Cl⁻).
Kommen sie mit Wasser in Kontakt, ziehen die Wassermoleküle die Ionen an, umlagern sie und lösen sie aus dem Kristallgitter. Dadurch werden die Ionen voneinander getrennt und können sich frei in der Lösung bewegen, was bedeutet, dass Natriumchlorid in Natrium-Ionen und Chlorid-Ionen zerfällt.
Die Ionen verteilen sich während des Lösungsprozesses gleichmäßig im Wasser. Dieser Vorgang wird in der nachfolgenden Animation noch einmal veranschaulicht.
Wähle dein Anforderungsniveau aus. Löse dann die Aufgabe zum Lösungsvorgang der Salze.
Ordne den Text und die Bilder in der richtigen Reihenfolge an!
Videoexperiment: Löslichkeit von Natriumchlorid in Wasser
Das nächste Videoexperiment ermöglicht es dir, die Löslichkeit von Natriumchlorid in Wasser detaillierter zu erforschen. Für diesen Versuch wirst du ein Protokoll anfertigen. Die bereitgestellte Protokoll-Anleitung begleitet dich Schritt für Schritt durch das Experiment. Nimm dir Zeit, folge den Anweisungen sorgfältig und achte darauf, die Reihenfolge genau einzuhalten.
§
© Juliana Zeidler
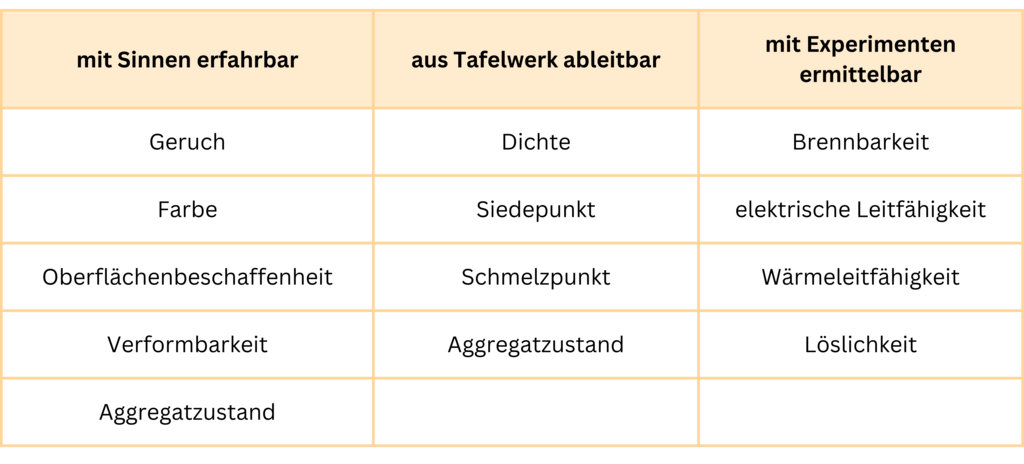
Elektrische Leitfähigkeit

§
Videoexperiment: Elektrische Leitfähigkeit
Das nächste Videoexperiment gibt dir die Möglichkeit, die elektrische Leitfähigkeit von Natriumchlorid genauer zu untersuchen. Dazu wirst du wieder ein Protokoll erstellen. Eine Hilfestellung leitet dich schrittweise durch das Experiment. Gehe die Schritte des Protokolls ruhig und sorgfältig durch und achte darauf, die Reihenfolge genau zu befolgen.
§
Urheber: Juliana Zeidler
Jetzt, nachdem du das Experiment durchgeführt hast, weißt du, dass Salze elektrischen Strom nur in flüssiger oder gelöster Form leiten können. Aber warum ist das so? Um das zu verstehen, wiederhole kurz, was wir im Alltag unter 'elektrischem Strom' verstehen.
Definition
Elektrischer Strom
Definition
Elektrischer Strom
Elektrischer Strom ist der gerichtete Transport von frei beweglichen elektrischen Ladungsträgern wie Elektronen oder Ionen.
§
Urheber: Juliana Zeidler
Die elektrische Leitfähigkeit einer Salzlösung
In festen Salzen sind die Ionen in einem regelmäßigen Kristallgitter fixiert, was bedeutet, dass sie sich nicht bewegen können und daher keinen elektrischen Strom leiten.
Aber in Salzlösungen oder Salzschmelzen sind die Ionen nicht mehr in einem Gitter gebunden, sondern frei beweglich. Wird eine elektrische Spannung angelegt, können sich die Ionen bewegen: Die positiven Ionen wandern zum negativen Pol und die negativen Ionen zum positiven Pol. Diese Bewegung der Ionen ermöglicht es, dass elektrischer Strom durch die Lösung oder Schmelze fließt und sie elektrisch leitend macht.
Die Animation zeigt dir noch einmal, wie die elektrische Leitfähigkeit von Salzen funktioniert.
Aufgabe
Beurteile die Aussage auf ihre Richtigkeit und erkläre deine Entscheidung.
Trockenes Badesalz ist ungefährlich, kann jedoch in Verbindung mit Wasser und elektrischen Geräten lebensbedrohlich werden.
Hohe Schmelz- und Siedetemperatur

§
© Digitale Lernwelten GmbH auf Basis von Canva
Salzlampe
Die hohen Schmelz- und Siedepunkte der Salze lassen sich durch ihre besondere Struktur und die Art der Bindungen zwischen den Teilchen erklären.
Salze setzen sich aus positiv und negativ geladenen Ionen zusammen, die sich in einem regelmäßigen Muster, dem Kristallgitter, anordnen. Die Kräfte, die zwischen den gegensätzlich geladenen Ionen wirken, sind sehr stark. Deshalb braucht es viel Energie, um diese Bindungen zu brechen und die Ionen voneinander zu trennen.
Videoexperiment: Schmelztemperatur von Natriumchlorid
Im nächsten Videoexperiment hast du die Gelegenheit, die Schmelztemperatur von Natriumchlorid genauer zu erforschen. Für diesen Versuch wirst du ein Protokoll anfertigen. Eine Hilfestellung für das Protokoll zeigt dir jeden Schritt des Experiments. Gehe die Anleitung ruhig und sorgfältig durch und achte darauf, die festgelegte Reihenfolge genau zu befolgen.
§
© Juliana Zeidler
Merkwissen für deine Notizen
Merkwissen für deine Notizen
Eigenschaften von Kochsalz
- Zustand: Fest (kristallin)
- Eigenschaft: Spröde
- Löslichkeit: Löst sich gut in Wasser
- Schmelz- und Siedepunkt: Sehr hoch
- Elektrische Leitfähigkeit:
- Als reiner Feststoff: Nicht leitend
- In Wasser gelöst: Leitend
Erklärung zur Leitfähigkeit:
Festes Kochsalz leitet keinen elektrischen Strom, weil die Ionen im Ionengitter festgelegt sind und sich nicht bewegen können. Eine Lösung von Kochsalz in Wasser leitet Strom, weil die Ionen darin frei beweglich sind.
Aufgabe
Steckbrief zu Natriumchlorid
Erstelle einen Steckbrief für Natriumchlorid in deinen Aufzeichnungen. Verwende dabei das Format des Mustersteckbriefs zu Wasser (siehe unten), und trage die Inhalte dieses Moduls ein, die du benötigst.
Mustersteckbrief: Wasser
Mustersteckbrief: Wasser

§
© Digitale Lernwelten GmbH
Test zum Abschluss
Wähle ein Anforderungsniveau und löse dann den Abschlusstest zum Thema „Salze”.
Teste dein Wissen. Viel Erfolg!
Teste dein Wissen. Viel Erfolg!
Zum Abschluss: ein Feuerwerk
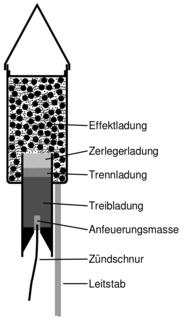
§
Urheber: Majo statt Senf
https://commons.wikimedia.org/wiki/File:Zylinder-Stabrakete.svg
So ist eine Stabrakete aufgebaut.
Hast du gewusst, dass Feuerwerke ohne Salze überhaupt nicht so farbenprächtig wären?
Bestimmte Salzverbindungen sorgen bei ihrer Verbrennung für spezifische Flammenfarben, die in den Effektladungen von Feuerwerkskörpern verwendet werden.

§
Urheber: Hegelrast
Von links nach rechts: Lithiumchlorid, Strontiumchlorid, Calciumchlorid, Natriumchlorid, Bariumchlorid, Trimethylborat, Kupferchlorid, Cäsiumchlorid und Kaliumchlorid
Die Vielfalt der Salze
Diese Bilder vermitteln dir einen kleinen Einblick in weitere Salze.