Als Van-der-Waals-Kräfte werden in der Chemie Anziehungskräfte zwischen zwei Teilchen zusammengefasst, welche in einer elektrostatischen Anziehung eines positiven und eines negativen Pols begründet sind. Der Namensgeber ist Johannes van der Waals. Er war Professor an der Universität Amsterdam und bekam den Nobelpreis für Physik im Jahr 1910.

§
Urheber: Digitale Lernwelten GmbH erstellt mit Canva
Inter- und intramolekulare Wechselwirkungen
Übersicht

Johannes van der Waals (1837–1923)
Die Dipol-Dipol-Kraft wirkt zwischen zwei Dipolmolekülen. Eine partiell positiv geladene Seite des einen Moleküls zieht eine partiell negativ geladene Seite eines anderen Moleküls an. Die Dipol-Dipol-Kraft wirkt sowohl zwischen gleichartigen als auch unterschiedlichen Molekülen.
Beispiel: Bromwasserstoff (HBr)
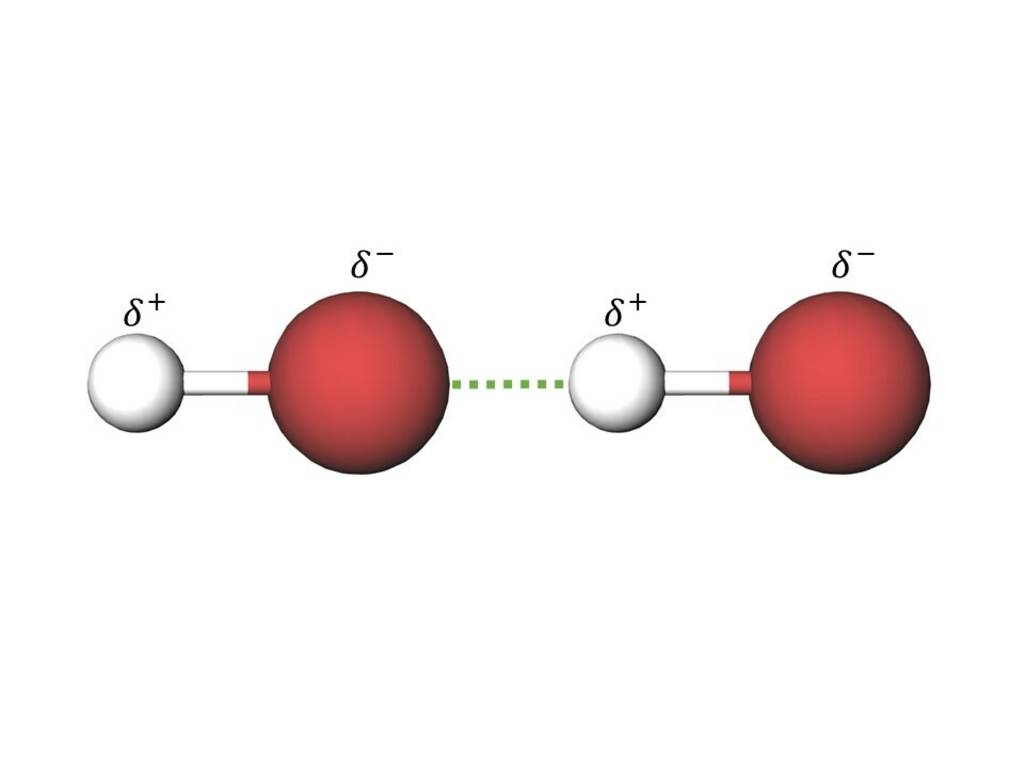
§
Urheber: Digitale Lernwelten GmbH
Anziehung von zwei Bromwasserstoffmolekülen
Eine besondere Form der Dipol-Dipol-Kraft ist die Wasserstoffbrücke. Sie entsteht durch die Anziehung zwischen einem stark partiell positiv geladenem Wasserstoffatom des einen Moleküls und einem stark partiell negativ geladenen Atom des anderen Moleküls. Die Voraussetzung dafür ist die Bindung von Wasserstoff an ein Elementatom mit sehr hoher Elektronegativität. Beispielsweise Stickstoff-, Sauerstoff-, Fluor- oder Chloratome. Wasserstoffbrücken sind die stärkste inter- und intramolekulare Wechselwirkung, sie wirken zwischen gleichartigen oder zwischen unterschiedlichen Molekülen.
Beispiel: Ammoniak (NH3)
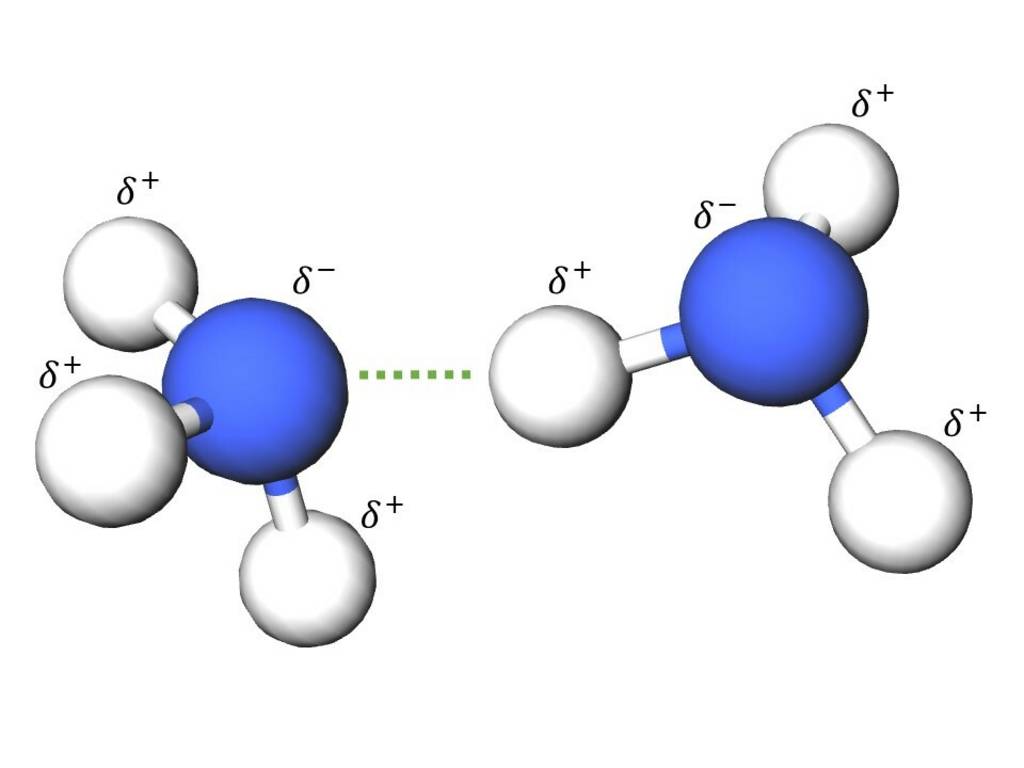
§
Urheber: Digitale Lernwelten GmbH
Anziehung von zwei Ammoniakmoleküle
Die Van-der-Waals-Kräfte (London-Kräfte) wirken zwischen allen Teilchen und sind besonders bei unpolaren Teilchen ein wichtiger Part. Durch die Bewegung von Elektronen in Bindungen oder in der Atomhülle entstehen kurzlebige Dipole. Diese temporäreren Dipole beeinflussen die Elektronenverteilung in den benachbarten Molekülen oder Atomen. Dadurch können in diesen ebenfalls kurzlebige Dipole ausgelöst werden. Die Anziehung zwischen den temporären Dipolen schafft nur einen schwachen Zusammenhalt von Teilchen. Van-der-Waals-Kräfte sind die schwächsten inter- und intramolekularen Wechselwirkungen.
Beispiel: Pentan (C5H12)
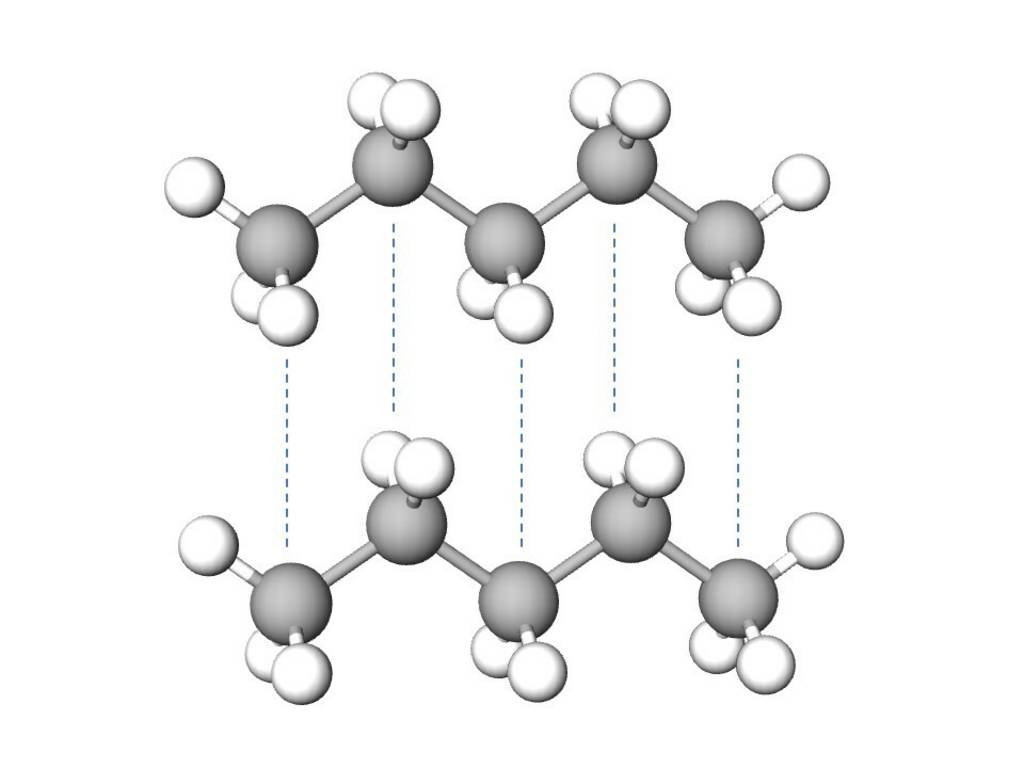
§
Urheber: Digitale Lernwelten GmbH
Anziehung von zwei Pentanmoleküle
Beim Lösen von Salzen in polaren Lösungsmitteln spielen die Wechselwirkungen zwischen Ionen und Dipolmolekülen eine wichtige Rolle, sie machen diesen Vorgang erst möglich. Ionen sind im Gegensatz zu den bisher betrachteten Teilchen nicht nur teilweise geladen, sondern tragen vollständige Ladungen. Wenn ein Salzkristall in ein polares Lösungsmittel gegeben wird, dann richten sich dessen Moleküle entsprechend ihrer Ladungsverteilung an der Oberfläche des Kristalls aus. Der negative Pol der Lösungsmittelmoleküle lagert sich an den Kationen und der positive Pol lagert sich an den Anionen an. Dadurch geschieht eine Ablösung der Ionen aus dem Gitter und deren vollständige Einhüllung durch Lösungsmittelmoleküle. In Wasser wird dieser Vorgang Hydratation genannt, in anderen, beispielsweise organischen Medien, heißt er Solvatation.
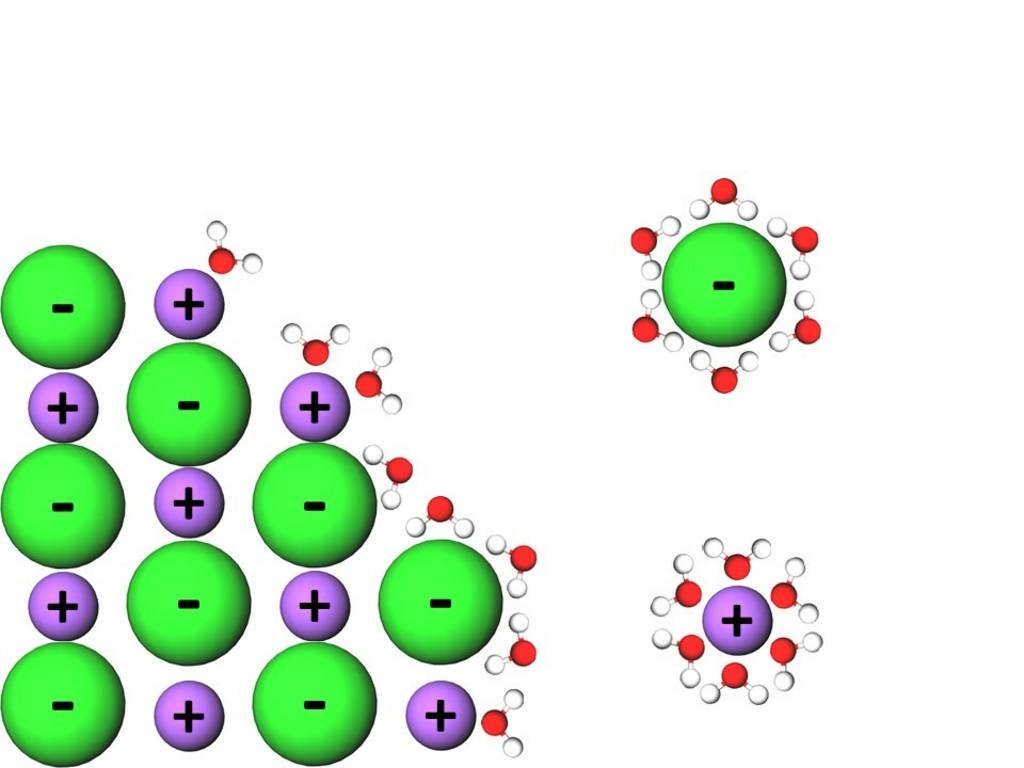
§
Urheber: Digitale Lernwelten GmbH
Auflösung von Kristall in Wasser
Vertiefung
Übersicht über Van-der-Waals-Kräfte
Vertiefung
Übersicht über Van-der-Waals-Kräfte
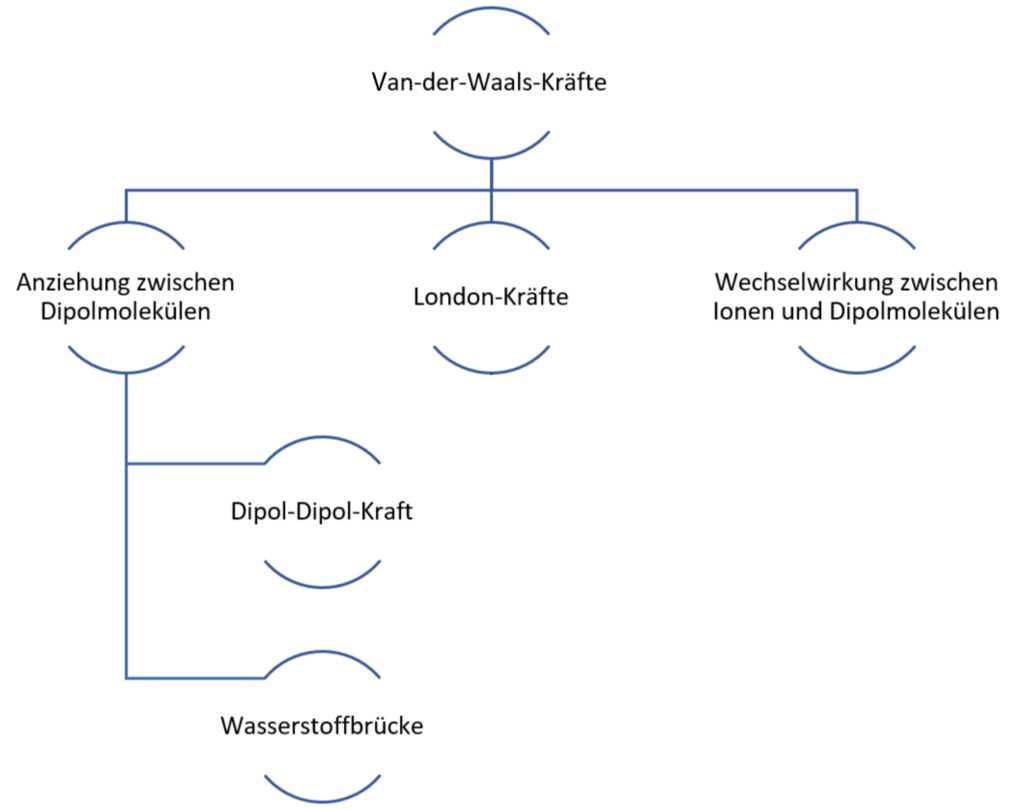
§
Urheber: Digitale Lernwelten GmbH
Übersicht der inter- und intramolekularen Wechselwirkungen
„Van-der-Waals-Kräfte“ ist eine andere Bezeichnung für „London-Kräfte“, die zwischen unpolaren Teilchen auftreten kann.
Zusammenhang zwischen Struktur und Eigenschaften
Siedetemperaturen
Die Stärke der wirkenden inter- und intramolekularen Wechselwirkungen ist neben dem Molekülgewicht entscheidend für die Siedetemperatur. Generell gilt: Je stärker die inter- und intramolekularen Wechselwirkungen, desto größer ist der Zusammenhalt der Teilchen untereinander, umso mehr Energie wird benötigt, um sie voneinander zu trennen und in die Gasphase zu befördern, entsprechend höher ist die Siedetemperatur.
Damit man die Stärke der inter- und intramolekulare Wechselwirkungen einschätzen kann, sind zwei Faktoren zu betrachten:
- Wenn Atome mit hoher Elektronegativität vorhanden sind deutet dies häufig darauf hin, dass es sich um ein Dipolmolekül handelt. In diesem Fall, wirken starke inter- und intramolekulare Anziehungskräfte.
- Die Oberfläche eines Moleküls bestimmt die Stärke der Van-der-Waals-Kräfte. Dabei gilt: Je größer die Moleküloberfläche, umso stärker die inter- und intramolekularen Wechselwirkungen. Besonders bei der Abschätzung von Siedetemperaturen von Strukturisomeren ist dieser Faktor wichtig.
Achtung: Zur einfacheren Darstellung organischer Moleküle wird im Folgenden die Skelettformel benutzt.
Übung
Übung
Übung
Siedetemperaturen
In den Bildern sind die Siedetemperaturen der folgenden Stoffe graphisch dargestellt:
i) NH3, PH3, AsH3, SbH3
ii) F2, Cl2, Br2, I2
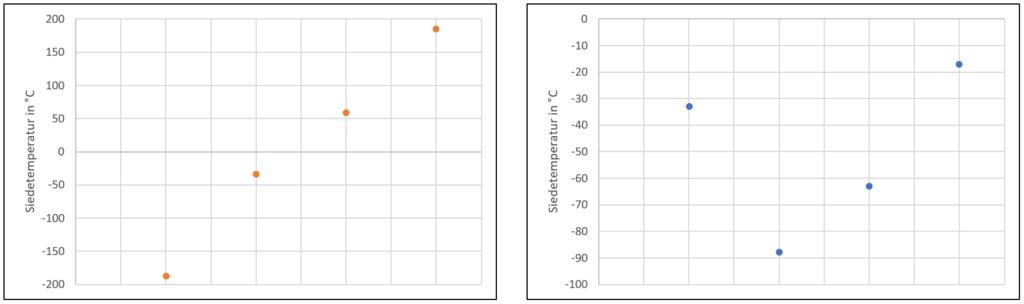
§
Urheber: Digitale Lernwelten GmbH
1) Ordne den Grafiken die passende Datenreihe zu!
2) Erläutere das Zustandekommen der Kurvenverläufe unter Nutzung deines Wissens über inter- und intramolekulare Wechselwirkungen!
Löslichkeit
Wie viel eines Stoffes, sich in einer bestimmten Menge eines Lösungsmittels löst, ist eine stoffspezifische Größe. Sie wird als Löslichkeit bezeichnet. Stoffe die in Wasser sehr gut löslich sind, sind Kochsalz, Ethanol (Trinkalkohol) und Saccharose (Haushaltszucker).
Experiment
Im nachfolgenden Experiment wird die Löslichkeit dreier Stoffe – Speiseöl, Kupfersulfat und Tinte – in den Lösungsmitteln Wasser und Waschbenzin untersucht.
Waschbenzin ist ein Stoffgemisch und besteht vorrangig aus Kohlenwasserstoffen.
Merksatz
Formuliere einen eigenen Merksatz, der die Bedingung der Löslichkeit zweier Stoffe ineinander beschreibt.
Trockeneis
Trockeneis ist festes Kohlenstoffdioxid, es wird häufig zur Kühlung oder für beeindruckende Showeffekte verwendet.
1) Erläutere die Bindungsverhältnisse im Kohlenstoffdioxidmolekül.
2) Erkläre, warum Kohlenstoffdioxid einen festen Aggregatzustand haben kann. Nutze dafür dein Wissen über inter- und intramolekulare Wechselwirkungen.