Auch wenn Salze in ihrem Erscheinungsbild variieren können, ist ihr Aufbau doch erstaunlich ähnlich. In diesem Kapitel lernst du, wie Salze strukturiert sind und warum sie Kristallformen ausbilden.

§
© Digitale Lernwelten GmbH auf Basis von Canva
Unter dem Mikroskop: Salzkristalle
Natriumchlorid
Aufbau von Salzen

§
© Digitale Lernwelten GmbH auf Basis von Canva
ein Kochsalzkristall
Jedes Salz besteht aus Salzkristallen, und diese Kristalle setzen sich aus einzelnen Ionen zusammen.
Aber was ist eigentlich ein Ion?
Vom Atom zum Ion
Atome sind elektrisch neutrale Teilchen, in deren Atomkern sich immer gleich viele positive Protonen (p⁺) wie negative Elektronen (e⁻) in der Atomhülle befinden.
Die Grafik zeigt den Aufbau eines Natrium- und eines Chloratoms:
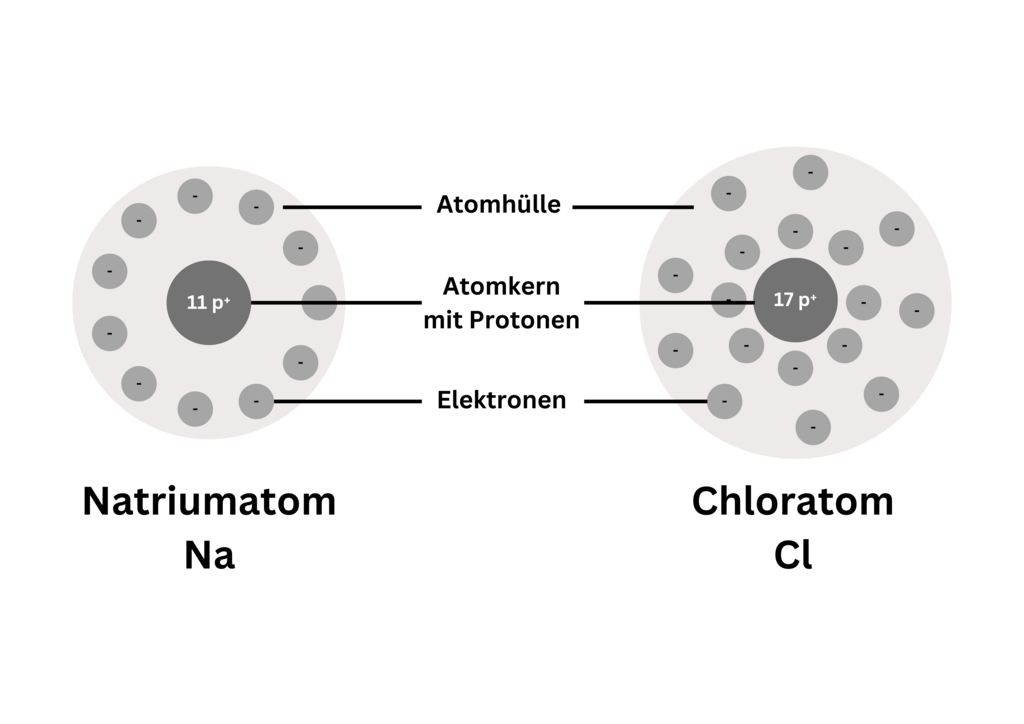
§
Urheber: Juliana Zeidler
Natrium- und Chloratom: Aufbau
Vertiefung
Vertiefung
Sieh dir nun das Video an. Hier wird dir die Bildung von Ionen anhand von Kochsalz (Natriumchlorid) erklärt.
§
© Digitale Lernwelten GmbH
Definition
Ionen
Definition
Ionen
Ionen sind Teilchen, die eine elektrische Ladung tragen.
Man unterscheidet zwischen Ionen mit positiver Ladung, die als Kationen bezeichnet werden, und solchen mit negativer Ladung, die Anionen genannt werden.
In den folgenden Tabs erhältst du einen Überblick über die verschiedenen Arten von Ionen, die entweder einfach oder mehrfach geladen sein können.

§
Urheber: Juliana Zeidler

§
Urheber: Juliana Zeidler
Wenn du das Video über die Entstehung von Ionen aufmerksam verfolgt hast, wirst du diese Aufgaben wahrscheinlich ohne Schwierigkeiten bewältigen können.
Merkwissen für deine Notizen
Merkwissen für deine Notizen
Aufbau aus Ionen
- Kochsalz setzt sich aus Ionen zusammen.
- Ein Ion ist ein Teilchen mit einer Ladung, die entweder mehr oder weniger Elektronen als Protonen besitzt.
- Es existieren Ionen mit positiver Ladung, die Kationen genannt werden, und solche mit negativer Ladung, bekannt als Anionen.
- In Kochsalz finden wir positiv geladene Natrium-Ionen und negativ geladene Chlorid-Ionen.
Daher wird Kochsalz chemisch als Natriumchlorid bezeichnet, mit der chemischen Formel NaCl.
Vergleich: Atom und Ion
Übernimm die folgende Tabelle in deine Notizen und vervollständige sie.
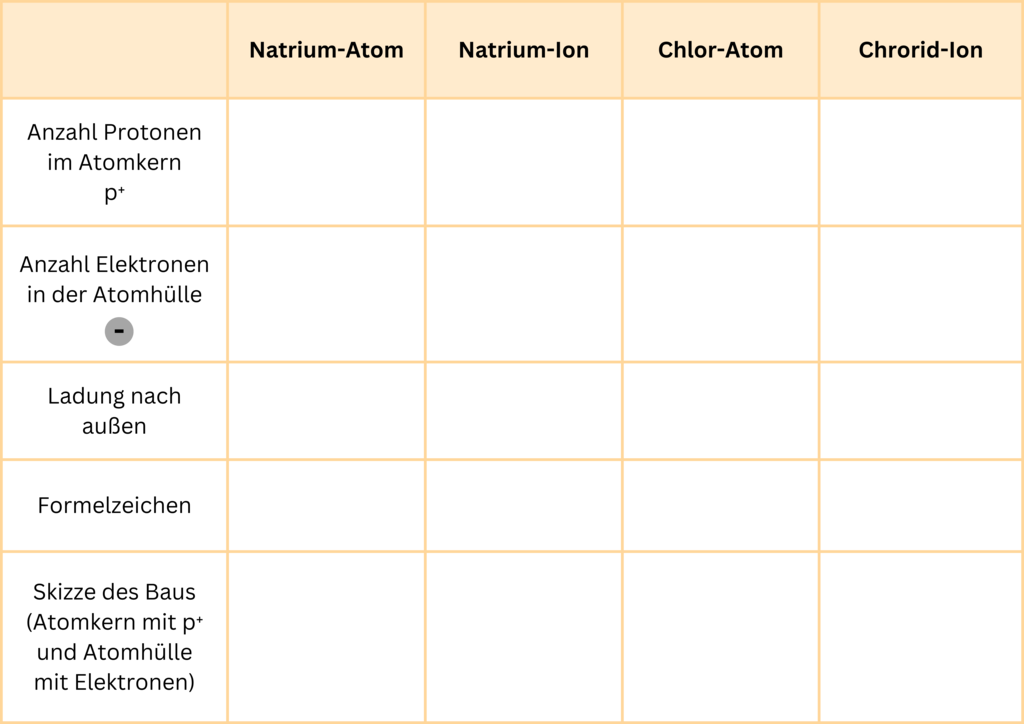
§
Urheber: Juliana Zeidler
Vertiefung
Vertiefung
Warum Salze Kristalle bilden
Jedes Salz setzt sich aus Ionen zusammen. Diese Ionen verhalten sich ähnlich wie unterschiedliche Pole eines Magneten, die sich gegenseitig anziehen, und bilden dadurch Kristallstrukturen. Die genaue Funktionsweise dieser Strukturbildung wird im nächsten Video erläutert.
§
© Digitale Lernwelten GmbH
Definition
Ionenbindung
Definition
Ionenbindung
Eine Ionenbindung entsteht, wenn sich positiv geladene und negativ geladene Ionen durch ihre elektrische Ladung stark anziehen.
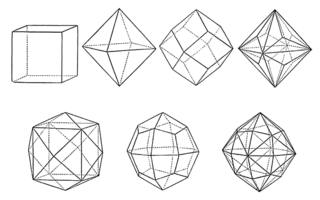
Jedes Salz bildet sein eigenes einzigartiges Kristallgitter. Diese Einzigartigkeit entsteht durch die spezielle Anordnung der Ionen im Ionengitter, wodurch sich viele verschiedene Kristallstrukturen ergeben.
Aufgaben zum Üben
Sichere dein Verständnis von Ionenbindungen und der Kristallbildung bei Salzen, indem du die nachfolgenden Übungsaufgaben bearbeitest.
Aufgabe A: Natriumchloridkristall
Platziere die Natrium- und Chlorid-Ionen im leeren Ionengitter. Denke daran, dass sich Teilchen mit gleicher Ladung gegenseitig abstoßen, während sich Teilchen mit entgegengesetzten Ladungen anziehen.
Aufgabe B: Ionenbindung
Experiment
Züchten von Salzkristallen
Experiment
Züchten von Salzkristallen
Lies das beigefügte Versuchsprotokoll, das beschreibt, wie man Salzkristalle züchtet.
Hinweis: Führe dieses Experiment nicht alleine durch, sondern nur in Anwesenheit und unter Aufsicht einer erwachsenen Person.
Merkwissen für deine Notizen
Merkwissen für deine Notizen
Die Bindung im Kochsalzkristall
- Natrium- und Chlorid-Ionen ziehen sich aufgrund ihrer entgegengesetzten Ladungen an.
- Diese Verbindung zwischen den Ionen wird als Ionenbindung bezeichnet.
- Die Ionen sind in einem Gitter, dem sogenannten Ionengitter, regelmäßig angeordnet.
- Im Ionengitter sind Natrium- und Chlorid-Ionen in gleicher Zahl vorhanden.
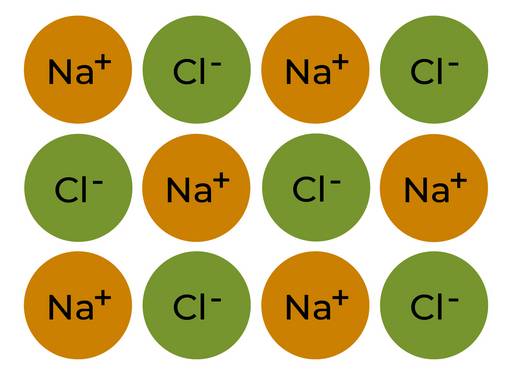
§
© Digitale Lernwelten GmbH
Die Anordnung von Ionen im Natriumchloridkristall