In der folgenden Darstellung sind die molekularen Strukturen von organischen Ausgangsstoffen dargestellt, die entweder zur Herstellung anderer Stoffe verwendet werden oder als Brennstoff dienen. Die Summenformel für jeden dieser Ausgangsstoffe ist ebenfalls angegeben:
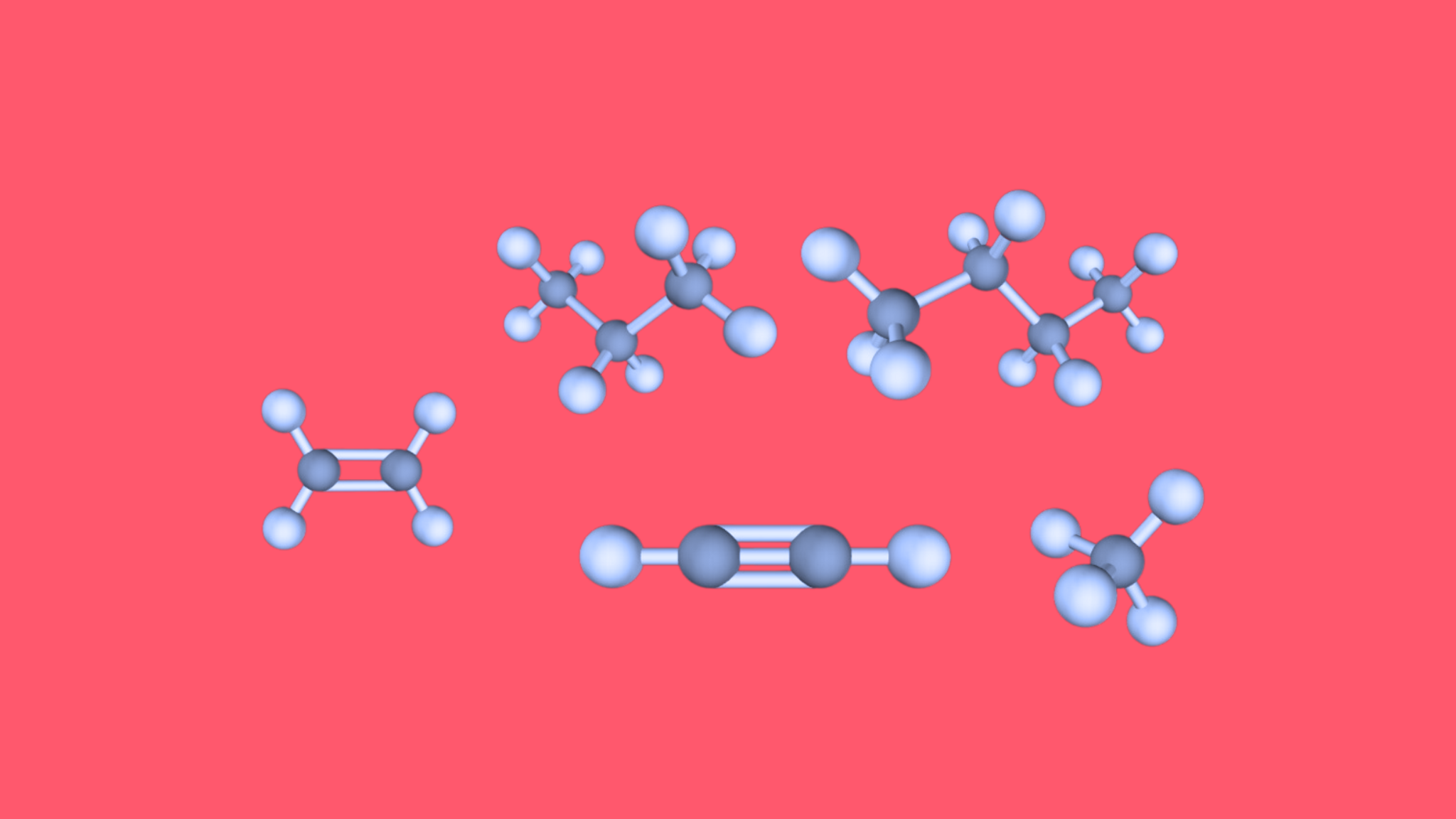
§
© Digitale Lernwelten GmbH
Kohlenwasserstoffe
§
© Digitale Lernwelten GmbH
Molekularer Aufbau organischer Moleküle
Moleküldarstellung auf Papier
Die Moleküle werden in der Darstellung nicht nur dreidimensional betrachtet, sondern auch auf einer zweidimensionalen Ebene gezeichnet. Die seitlich nach vorne und hinten abstehenden Bindungen werden in dieser Darstellung in einer Ebene gezeichnet. Dies ergibt die sogenannte Strukturformel, wie sie in der Abbildung dargestellt ist.
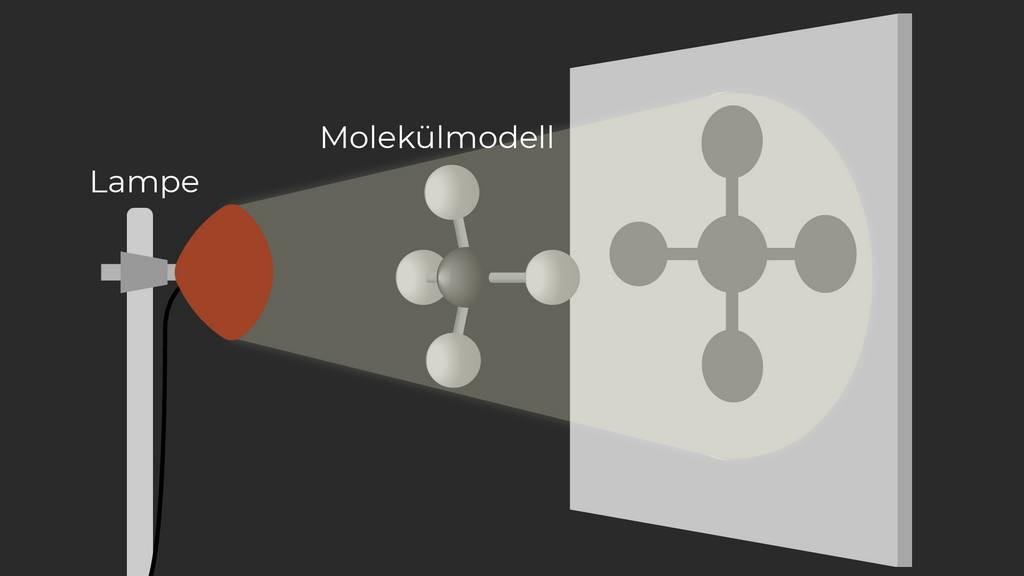
§
© Digitale Lernwelten GmbH
Ordne zu!
Ordne im Memory die Strukturformeln und Summenformeln einander zu!
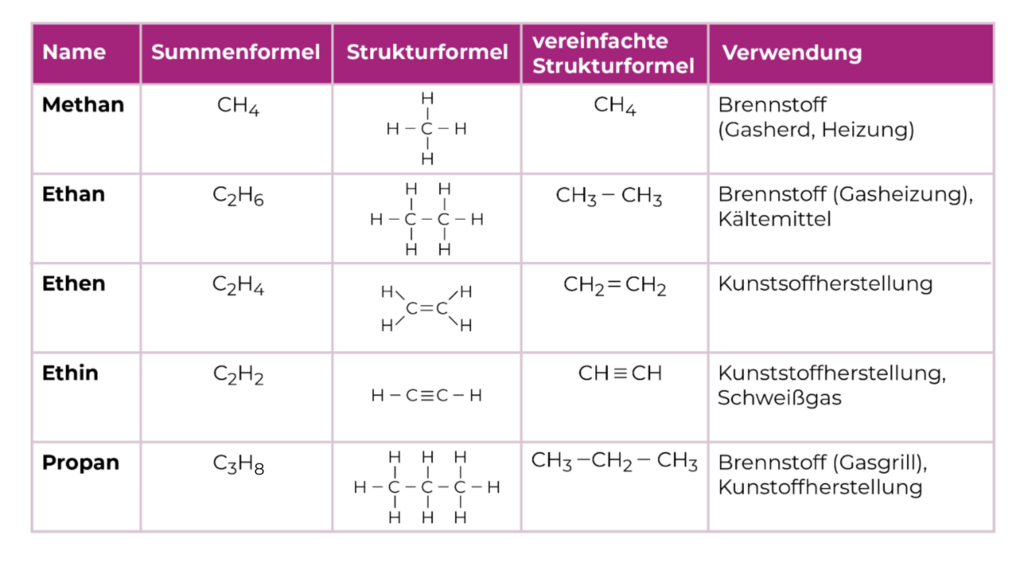
Methan (CH4) ist ein farb- und geruchloses Gas mit einem Schmelzpunkt von -182,6 °C und einem Siedepunkt von -161,7 °C. Es gehört zu den einfachsten Verbindungen der Alkane und wird über Pipelines und Gasnetze in städtischen Gebieten transportiert. In Häusern mit Gasanschlüssen wird Methangas für Heizungszwecke und den Betrieb von Gasherden verwendet. Bei der Verbrennung von Methan entstehen Kohlendioxid und Wasser. Methan wird auch in Mooren und im Verdauungstrakt von Kühen erzeugt.
Mit diesem interaktiven 3-D-Modell kannst du das Methanmolekül in alle Richtungen drehen:
Ethan (C₂H₆) ist ein farb- und geruchloses Gas mit einem Schmelzpunkt von -183,3 °C und einem Siedepunkt von -88,6 °C. Es wird hauptsächlich zur Beheizung verwendet, findet aber auch Anwendung als Kältemittel. Darüber hinaus dient Ethan als Ausgangsstoff für die Herstellung von Ethen, einer Verbindung mit großer Bedeutung in der chemischen Industrie.
Mit diesem interaktiven 3-D-Modell kannst du das Molekül in alle Richtungen drehen:
Ethen (C₂H₄) ist ein farbloses Gas mit einem süßlichen Geruch. Es hat einen Schmelzpunkt von -169,18 °C und einen Siedepunkt von -103,8 °C. Ethen ist ein bedeutender Ausgangsstoff in der chemischen Industrie und wird in vielen chemischen Reaktionen verwendet. Es kann sowohl aus Erdöl als auch von bestimmten Pflanzen produziert werden. Industriell kann Ethen auch zur Herstellung fester Produkte wie Kunststoffe (z. B. Polyethylen) verwendet werden.
Mit diesem interaktiven 3-D-Modell kannst du das Molekül in alle Richtungen drehen:
Ethin (C₂H₂) ist ein farbloses Gas mit einem sublimierenden Punkt von -84,03 °C. Es hat einen knoblauchartigen Geruch. Natürlich kommt Ethin nicht vor, kann jedoch industriell aus Erdöl gewonnen werden. Früher wurde Ethin als Brennstoff in Karbidlampen verwendet, die für Fahrzeugbeleuchtung und in Höhlen genutzt wurden. Es wird auch als Schweißgas verwendet. Industriell kann Ethin auch zur Herstellung fester Produkte wie Kunststoffe (z. B. Polyvinylchlorid) genutzt werden.
Mit diesem interaktiven 3-D-Modell kannst du das Molekül in alle Richtungen drehen:
Propan (C₃H₈) ist ein farbloses Gas mit einem Schmelzpunkt von -187,7 °C und einem Siedepunkt von -42,1 °C. Es entsteht durch die Zersetzung anderer Kohlenwasserstoffe. Propan ist in Gasflaschen erhältlich und wird als Autogas, in Gasherden und in Löt- und Schweißgeräten verwendet, wo es verbrannt wird. Es kann auch als Kältemittel in Wärmepumpen eingesetzt werden. Bei unbeabsichtigtem Austritt in geschlossenen Räumen, wie einem Keller, kann sich Propan am Boden ansammeln und bei Einatmen zum Ersticken führen.
Mit diesem interaktiven 3-D-Modell kannst du das Molekül in alle Richtungen drehen:
Merkwissen – Bau von Kohlenwasserstoffen
Merkwissen – Bau von Kohlenwasserstoffen
Übernimm die folgenden Informationen in dein Heft.
Kohlenwasserstoffe
Die Kohlenwasserstoffe bilden eine Gruppe chemischer Verbindungen, die ausschließlich aus Kohlenstoff und Wasserstoff bestehen. Die Atome in den Molekülen der Kohlenwasserstoffe sind durch Atombindungen miteinander verbunden. Diese Verbindungen können sowohl ringförmige als auch kettenförmige Moleküle bilden.
§
© Digitale Lernwelten GmbH
Steckbrief
Steckbrief
§
© Digitale Lernwelten GmbH
Mustersteckbrief Wasser
Mustersteckbrief Wasser

§
© Digitale Lernwelten GmbH
Aufgabe
Bindungstypen
Wie du bereits festgestellt hast, kann ein Kohlenstoffatom Verbindungen mit vier einzelnen Wasserstoffatomen eingehen. Dies geschieht durch Bildung von Einfachbindungen, also einer Atombindung zwischen den Atomen. Im Fall von Methan gibt es vier dieser Einfachbindungen.
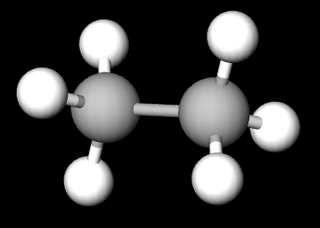
§
Ethan – ein Molekül mit Einfachbindungen
Das Ethan-Molekül, bestehend aus zwei Kohlenstoffatomen und sechs Wasserstoffatomen, weist insgesamt sieben Einfachbindungen auf.
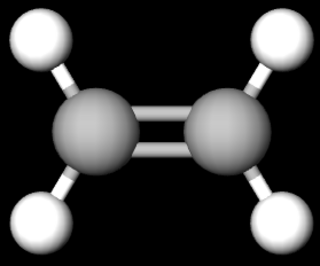
§
Ethen – ein Molekül mit mehreren Einfachbindungen und einer Doppelbindung
Beim Betrachten von Ethen fällt auf, dass dieses Molekül nur vier Wasserstoffatome besitzt. Im Gegensatz zu Ethan, bei dem die beiden Kohlenstoffatome die maximale Anzahl von sechs Wasserstoffatomen haben, bildet Ethen stattdessen eine zusätzliche Bindung zwischen den beiden Kohlenstoffatomen aus. In diesem Molekül finden sich also vier Einfachbindungen zu den Wasserstoffatomen, aber zwischen den Kohlenstoffatomen existiert eine Doppelbindung, die aus zwei Atombindungen besteht.
Es gibt bei den Kohlenwasserstoffen häufig Moleküle, in denen neben Einfachbindungen zum Wasserstoff auch Doppel- oder sogar Dreifachbindungen (drei Atombindungen) (z. B.) Ethin, zwischen benachbarten Kohlenstoff-Atomen auftreten. Diese Bindungen werden auch Mehrfachbindungen genannt.
Moleküle bauen und Bindungen analysieren
Ermittle die maximale Anzahl von Wasserstoffatomen, die in einem Kohlenwasserstoff-Molekül mit drei Kohlenstoffatomen gebunden sein können. Anschließend untersuche, ob das betrachtete Molekül zwei, drei oder vier Einfachbindungen zwischen den Kohlenstoffatomen aufweist.
Erstelle ein Molekül aus drei Kohlenstoffatomen und füge Wasserstoffatome hinzu. Untersuche dann in der 3-D-Ansicht, ob das Molekül Doppel- oder Einfachbindungen zwischen den Kohlenstoffatomen aufweist. Du kannst weitere Experimente durchführen, um dies zu überprüfen!
So gehst du Schritt für Schritt vor:
- Klicke auf „Spielwiese“, um die Animationsfläche zu öffnen.
- Deine Aufgabe ist es, Moleküle zu erstellen, die ausschließlich aus Kohlenstoff und Wasserstoff bestehen.
- Wenn das erstellte Molekül in der Realität existiert, wird der Name des Moleküls angezeigt, zusammen mit einer Schaltfläche „3D“.
- Klicke auf die „3D“-Schaltfläche und dann auf das Symbol unten rechts, um zu überprüfen, ob das Molekül Doppel- oder Einfachbindungen aufweist.
Die Vielfalt der organischen Moleküle resultiert aus ihrer unterschiedlichen Zusammensetzung, obwohl sie aus wenigen verschiedenen Atomen bestehen. Diese Vielfalt führt zu variierenden Eigenschaften. Zum Beispiel unterscheiden sich Moleküle in ihrem Gewicht, wodurch einige schwerer und andere leichter sind. Größere Kohlenwasserstoffmoleküle lösen sich beim Erhitzen nicht so leicht wie kleinere, was dazu führt, dass Ethan bei Raumtemperatur ein Gas ist, während Oktan, ein Kohlenwasserstoff mit acht Kohlenstoffatomen, eine Flüssigkeit ist. Kohlenwasserstoffe mit 17 oder mehr Kohlenstoffatomen sind bei Raumtemperatur fest und finden Anwendung beispielsweise bei der Herstellung von Kerzenwachs.
Aggregatzustände zuordnen
Ordne oben gezeigten Moleküle ihren Erscheinungsformen in der Destillationskolonne zu.